Teste genético de BRCA1 e BRCA2: quando está indicado?
O câncer de mama (CM) é o tipo de câncer mais comum entre as mulheres no Brasil e no mundo (depois do câncer de pele não-melanoma), podendo raramente também ocorrer em homens. Essa doença é relativamente rara antes dos 35 anos, sendo que a partir dessa idade sua incidência cresce progressivamente, em especial após os 50 anos. Sabe-se que existem diversos fatores de risco para o câncer de mama relacionados ao estilo de vida e a exposições ambientais, como o tabagismo, sedentarismo, obesidade, uso de hormônios, amamentação e número de gestações. Esses fatores ambientais são responsáveis pelos chamados casos isolados ou esporádicos de CM. Em torno de 10% dos tumores malignos da mama são hereditários, ou seja, passam de geração para geração numa mesma família, devido a alterações genéticas herdadas de um dos pais.
Desses 10% das pacientes com os chamados CM hereditário, dois genes são os principais responsáveis: BRCA1 e BRCA2. Estima-se que, conjuntamente, eles representem em torno de 60% dos casos de CM. Esse percentual, que pode variar dependendo da população estudada, mostra a grande importância desses dois genes nos casos de CM hereditário. O restante dos casos ocorre devido a alterações em genes menos frequentemente envolvidos, como por exemplo STK11, TP53, BARD1, PALB2, ATM, PTEN, NBN, NF1, RAD50, CDH1, BRIP1 e CHEK2 (ver também https://www.infomama.com.br/blog/risco-genetico-de-cancer-de-mama/). Cabe ressaltar que muitos casos com história clínica e história familiar altamente sugestivas de câncer hereditário podem ter a testagem de todos esses genes normais, indicando que muito possivelmente existam outros genes responsáveis pelo câncer de mama e que ainda não foram descritos.
A história clínica e familiar pode nos fornecer uma série de informações acerca de um risco aumentado de mutações em BRCA, como por exemplo:
(a) ocorrência de câncer de mama em idade jovem (antes dos 50 anos);
(b) câncer de mama bilateral (história de câncer nas 2 mamas, no mesmo momento ou em momentos diferentes);
(c) câncer de mama e câncer de ovário na mesma paciente ou em um mesmo familiar;
(d) dois ou mais casos de tumores relacionados ao BRCA1/2 (câncer de mama, ovário, melanoma, próstata, pâncreas) em parentes do mesmo lado da família (paterno ou materno);
(e) câncer de mama em homens;
(f) câncer de mama do tipo triplo-negativo (ver https://www.infomama.com.br/blog/tipos-de-cancer-de-mama/);
(g) etnia judaica Ashkenazi.
Todos os fatores acima são fundamentais a serem considerados para a indicação de avaliação genética.
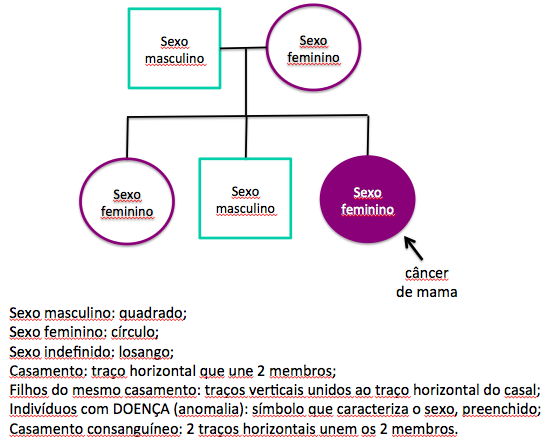
Uma vez identificada a suspeição de câncer hereditário e a possível indicação de testagem de BRCA1/2, a avaliação com o médico geneticista é recomendada. Nesse momento, o médico, através da revisão da história familiar, elaboração do heredograma (diagrama que descreve a história familiar; figura 1), revisão de exames anatomopatológicos da paciente e familiares afetados, bem como cálculos de risco e critérios clínicos, definirá a indicação ou não da realização da testagem genética. A partir daí, o aconselhamento genético é recomendado antes e depois do teste, devendo ser realizado por um profissional com experiência em genética do câncer.
Durante o aconselhamento genético, muitos aspectos deverão ser abordados, como:
– adequação dos testes genéticos (o mais bem indicado para o caso);
– implicações médicas de um resultado de teste positivo ou negativo;
– possibilidade de um resultado de teste não ser informativo;
– riscos psicológicos e os benefícios do resultado;
– riscos de transmissão hereditária de uma mutação (ou seja, passar os genes alterados para os filhos);
– opções de manejo e rastreio (testes de prevenção ou de diagnóstico precoce) subsequentes (não só para a paciente, como também para seus familiares).
Figura 1 – Heredograma
Critérios utilizados para definir a indicação (ou não) da testagem genética
Um dos pontos frequentemente questionados é de quais são os critérios utilizados para definir a indicação (ou não) da testagem genética. Esse é um processo complexo, que envolve uma série de critérios clínicos que variam entre diferentes diretrizes médicas (como por exemplo, NCCN, USPTF, ANS/Brasil, ASCO) e que podem ser complementados através de ferramentas de cálculo de risco de ocorrência de mutação através de programas específico (como por exemplo, PennII risk model, Myriad calculator, Manchester Score). O uso integrado dessas ferramentas e critérios clínicos com a história clínica de cada caso em particular são essenciais para a tomada de decisão, buscando o melhor desfecho para cada paciente. Dessa forma, a análise da indicação da realização de testagem genética para BRCA1/2 deve ser realizada de uma forma ampla e compreensiva, buscando analisar os diferentes critérios e riscos de mutação genética, com o objetivo de determinar de forma correta a necessidade ou não para cada paciente em particular.
Atualmente, painéis genéticos que incluem a testagem de múltiplos genes em um único exame (coleta) estão cada vez mais disponíveis, surgindo como uma nova opção para a investigação genética desses pacientes. Os painéis são elaborados por cada laboratório, que pode incluir mais ou menos genes, e ser direcionado somente para genes de alto risco, ou incluir também os chamados genes de baixo ou moderado risco. A decisão de utilizar um painel genético deve seguir o mesmo racional da indicação de teste de um único gene: avaliar a indicação, ter o aconselhamento genético realizado (agora para as especificidades de todos os genes incluídos no painel) e determinar as especificidades do manejo (medidas preventivas associadas ao resultado). Os painéis genéticos são especialmente úteis nos casos em que a história clínica e familiar pode ser explicada por mutações em dois ou mais genes (a família avaliada preenche critérios clínicos para mais de um tipo de síndrome de predisposição hereditária ao câncer).

Osvaldo Artigalás
Médico Geneticista
Porto Alegre, RS
Referências
1.Kast K, Schmutzler RK, Rhiem K et al. Validation of the Manchester scoring system for predicting BRCA1/2 mutations in 9,390 families suspected of having hereditary breast and ovarian cancer. Int J Cancer. 2014 Nov 15;135(10):2352-61.
2.The Penn II Risk Model, BRCA 1 and BRCA 2 Mutation Predictor. https://pennmodel2.pmacs.upenn.edu/penn2/
3.BRCA Calculator – MyriadPro. http://www.myriadpro.com/brca-risk-calculator/
4.NCCN. National Comprehensive Cancer Network criteria for consideration of BRCA1/2 genetic testing. https://www.nccn.org/professionals/physician_gls/pdf/genetics_screening.pdf
5.U.S. Preventive Services Task Force. Genetic risk assessment and BRCA mutation testing for breast and ovarian cancer susceptibility: recommendation statement. Ann Intern Med 2005; 143:355.
6.NICE. National Institute for Health and Care Excellence. Familial breast cancer: Classification and care of people at risk of familial breast cancer and management of breast cancer and related risks in people with a family history of breast cancer. NICE Guideline CG 164. June 2013. URL: http://www.nice.org.uk/ guidance/cg164.
7.INCA. Instituto Nacional de Câncer José Alencar Gomes da Silva. Câncer de mama – http://www2.inca.gov.br/wps/wcm/connect/tiposdecancer/site/home/mama/cancer_mama
8.Lincoln SE, Kobayashi Y, Anderson MJ et al. A Systematic Comparison of Traditional and Multigene Panel Testing for Hereditary Breast and Ovarian Cancer Genes in More Than 1000 Patients. J Mol Diagn. 2015 Sep;17(5):533-44.
9.LaDuca H, Stuenkel AJ, Dolinsky JS et al. Utilization of multigene panels in hereditary cancer predisposition testing: analysis of more than 2,000 patients. Genet Med. 2014 Nov;16(11):830-7.
10.Tung N, Lin NU, Kidd J et al. Frequency of Germline Mutations in 25 Cancer Susceptibility Genes in a Sequential Series of Patients With Breast Cancer. J Clin Oncol. 2016 May 1;34(13):1460-8.

