Angiogênese tumoral: uma orquestra sem regente
A angiogênese é um processo complexo de formação de novos vasos sanguíneos, que envolve síntese de proteínas estimulatórias, degradação de matriz extracelular, divisão e migração celular e formação e maturação de novos vasos a partir de vasos pré-existentes. Em algumas doenças, a angiogênese é muito bem descrita: na artrite reumatoide, na retinopatia diabética e no câncer. E não podemos nos esquecer que ela não ocorre somente em quadros patológicos, mas em diversos processos fisiológicos como embriogênese, cicatrização, ciclo reprodutivo feminino e amamentação, entre outros.
Muito tem se falado de drogas-alvo para angiogênese nas últimas décadas, principalmente após a descoberta do VEGF, o fator de crescimento do endotélio vascular, em 1989. Contudo, a descoberta da formação de novos vasos já havia sido descrita há mais de dois séculos. Vale a pena relembrar as palavras do autor: “In short, whenever Nature has considerable operations going on, and those are rapid, then we find the vascular system in a proportionable degree enlarged” (Treatise, Hunter, J, 1794; tradução livre: “Resumindo, sempre que processos importantes ocorrem rapidamente na Natureza, encontramos o sistema vascular proporcionalmente ampliado”).
Apesar da expressão dos fatores de crescimento responsáveis pela angiogênese estar diretamente ligada à falta de oxigênio no tecido (hipóxia), a angiogênese não depende unicamente desse fator. Ela pode ocorrer devido à instabilidade genômica de alguns tumores e ao consequente aumento de expressão de genes para fatores de crescimento no tumor. A formação de novos vasos no câncer também pode ser estimulada por células inflamatórias no tecido e não somente por células tumorais, o que comprova ainda mais a complexidade desse processo.
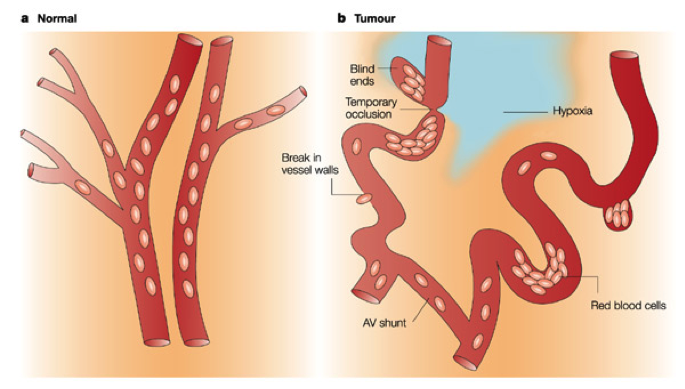
A orquestra da formação de novos vasos é tocada por diversos tipos celulares e pelos indutores ou inibidores por elas produzidos e, no câncer, a orquestra desregulada pode ter diversas consequências (Figura 1). Uma delas, é a produção excessiva de vasos sem conectividade, que possuem seu interior (lúmen) vazio, com fluxo de sangue errático, e assim, mesmo com novos vasos, não há superior distribuição de nutrientes e oxigênio para esse tecido maligno, sendo que esse tecido têm até diversas regiões necróticas (de células mortas).
Figura 1 – A diferença entre vasos normais hierarquicamente organizados (a) e os vasos produzidos no microambiente tumoral que são caóticos, dilatados e muitas vezes com fluxo lento (b). Retirado de Brown & Wilson, Nature Reviews Cancer, 4:437-447, 2004.
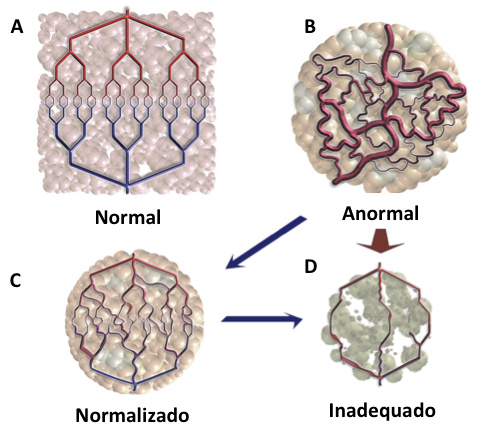
Para bloquear essa orquestra desregulada no câncer foram desenvolvidos diversos fármacos, que são amplamente utilizados. Dentre essa classe de fármacos, temos aprovado no Brasil para o tratamento de primeira linha de câncer de mama metastático, o bevacizumabe, que deve ser usado somente em terapia combinada com quimioterapia (paclitaxel ou capecitabina). Como mecanismo, o bevacizumabe se liga no receptor do fator de crescimento VEGF, chamado VEGF-R, que está fora das células, impedindo que seu ligante (o VEGF) se ligue e deflagre o processo da angiogênese. Assim, há uma redução da vasculatura anormal, que tende a se normalizar e, posteriormente, se tornar insuficiente para o desenvolvimento do tumor (Figura 2).
Figura 2 – Esquema das alterações na vasculatura tumoral durante a terapia anti-angiogênica. Podemos novamente observar a diferença da vasculatura normal (A) para a vasculatura tumoral anormal (B). Quando o fármaco anti-angiogênico é administrado, há uma reorganização da vasculatura (C) que pode se reduzir ao ponto de se tornar inadequada para suportar o crescimento do tumor (D). Retirado e traduzido de Jain, RK, Nature Medicine, 7(9): 987-989, 2001.
A adição de bevacizumabe ao tratamento de primeira linha do câncer de mama metastático promoveu mais tempo sem progressão da doença (chamado de sobrevida livre de progressão) porém não aumentou o tempo de vida para as pacientes (sobrevida global), quando comparado à quimioterapia apenas. Esse tipo de resultado para fármacos anti-angiogênicos não é incomum. Muitos ensaios clínicos de fase 3 demonstraram benefícios de sobrevida significativos; no entanto, a adição de um fármaco anti-angiogênico a terapias convencionais produziu, em geral, benefícios modestos para os pacientes. Atualmente, não está claro por que esses medicamentos clinicamente disponíveis que visam as mesmas vias angiogênicas produzem efeitos diferentes em modelos pré-clínicos, quando comparados aos resultados em humanos. Acredita-se que seja devido ao desenvolvimento de mecanismos compensatórios que remodelam o tecido tumoral.
Apesar de todos os esforços, a farmacologia por trás das drogas anti-angiogênicas ainda não é suficiente para impedir o progresso e erradicar tumores. Precisamos descobrir o regente dessa orquestra cheia de instrumentos para poder fazer dela um dos principais alvos da terapia moderna.

Renan Orsati Clara, PhD
Farmacêutico-Bioquímico
São Paulo, SP
Referências
- Hall, AP. T he role of angiogenesis in cancer. Comp Clin Path 2005;13:95-9.
- Pezzella F et al. Blood vessels and cancer much more than just angiogenesis. Cell Death Discovery 2015;1, 15064.
- Denko NC. Hypoxia, HIF1 and glucose metabolism in the solid tumour Nat Rev Cancer 2008;8:705-13.
- Carmeliet P. Mechanisms of angiogenesis and arteriogenesis. Nat Med 2000;6:389-96.
- Adair TH, Montani JP. Angiogenesis. San Rafael (CA), Morgan & Claypool Life Sciences, 2010.
- Hanahan D, Weinberg, RA. Hallmarks of cancer: the next generation. Cell 2011;144:646-74.
- Brown JM. Wilson WR. Exploiting tumour hypoxia in cancer treatment. Nature Reviews Cancer 2004;4:437-447.
- Jain RK. Normalizing tumor vasculature with anti-angiogenic therapy: a new paradigm for combination therapy. Nature Medicine 2001;7:987-9.
- Montero AJ et al. Bevacizumab in the treatment of metastatic breast cancer: friend or foe? Curr Oncol Rep 2012;14:1-11.
- Aalders KC et al. Anti-Angiogenic Treatment in Breast Cancer: Facts, Successes, Failures and Future Perspectives. Cancer Treat Rev 2017;53:98-110.
- Miller K, et al. Paclitaxel plus bevacizumab versus paclitaxel alone for metastatic breast cancer. N Engl J Med 2007;357:2666–76.
- Robert NJ, et al. RIBBON-1: randomized, double-blind, placebo-controlled, phase III trial of chemotherapy with or without bevacizumab for first-line treatment of human epidermal growth factor receptor 2-negative, locally recurrent or metastatic breast cancer. J Clin Oncol 2011;29:1252–60.

